smpn1jtb.sch.id – Teori asam basa Bronsted Lowry sangat bermanfaat bagi banyak orang, simak penjelasannya di bawah ini agar lebih paham!
Mempelajari teori asam basa bronsted lowry ini termasuk ke dalam salah satu konsep yang paling fundamental dalam kimia. Sebab, menjelaskan terkait proses reaksi asam basa tersebut bisa terjadi.
Teori ini sebenarnya juga telah dikembangkan langsung oleh sosok Johannes Nicolaus. Dirinya merupakan salah seorang ahli kimia asal Denmark tahun 1923. Sementara itu, juga ada Thomas Lowry, yang termasuk seorang ahli kimia asal Inggris, tahun 1923.
Teori Asam Basa Bronsted Lowry
Dalam Teori asam basa Bronsted Lowry ini, tentunya asam akan didefinisikan sebagai donor proton (H⁺). Sementara itu, untuk basa termasuk akseptor proton. Berikut ini penjelasan lengkap :
1. Donasi dan Penerimaan Proton
Teori Bronsted Lowry ini sendiri telah mendefinisikan asam sebagai salah satu zat yang nantinya nantinya bisa langsung mendonorkan proton. Sementara itu, pada bagian basa ini juga seringkali dijadikan sebagai zat yang mampu menerima proton.
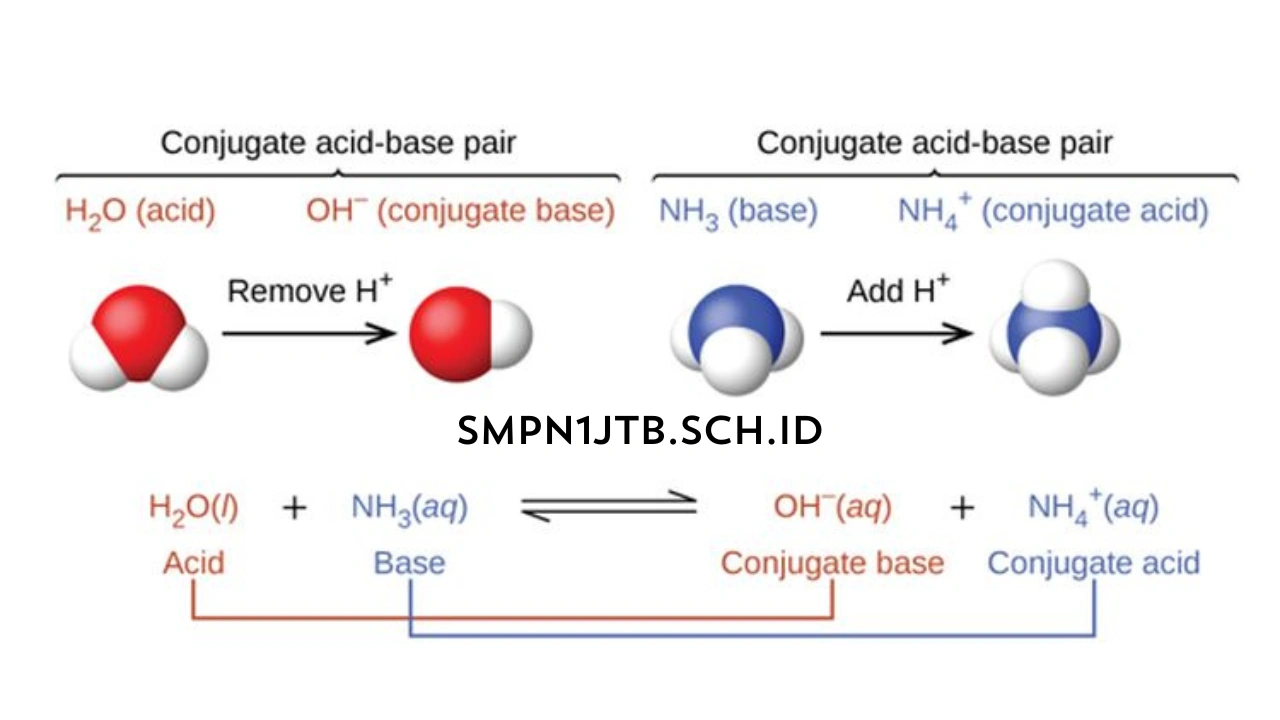
Contohnya saja yaitu reaksi yang terjadi antara asam klorida (HCl) serta air (H₂O):
HCl+H₂O>(H₃O⁺)+ Cl
Dalam reaksi tersebut, HCl ini nantinya juga akan langsung berfungsi sebagai asam. Hal tersebut karena ada beberapa hal yang telah mendonorkan proton ke molekul air. Sementara itu, untuk senyawa H₂O juga akan digunakan sebagai basa.
Hal tersebut karena telah menerima proton untuk bisa langsung membentuk ion hidronium (H₃O⁺).
2. Konsep dari Konjugasi Asam Basa
Teori satu ini sebenarnya juga telah memperkenalkan konsep pasangan dari konjugasi asam maupun basa. Saat asam telah berhasil mendonorkan proton, tentunya juga akan berubah menjadi basa konjugasinya.
Sementara itu, ketika sudah menerima proton, nantinya juga akan langsung berubah menjadi asam konjugasinya. Contohnya saja , dalam reaksi yang ada di atas, HCl yaitu asam.
Sedangkan Cl⁻ juga termasuk ke dalam basa konjugasinya. Sementara itu, untuk H₂O itu basa dan H₃O⁺ termasuk ke dalam asam yang konjugasinya.
Pasangan konjugasi tersebut sebenarnya juga sangatlah penting. Hal tersebut karena akan saling berkaitan dalam reaksi asam-basa.
3. Keseimbangan Dinamis dalam Reaksi Asam-Basa
Seringkali terjadi keseimbangan dinamis antara asam maupun basa dengan pasangan konjugasinya. Keseimbangan ini juga akan menunjukkan bahwa tidak ada reaksi yang sepenuhnya.
Bahkan, juga akan berjalan ke satu arah, namun kebanyakan reaksi tersebut berlangsung pada kedua arah sampai mencapai keseimbangan. Contohnya saja, dalam larutan air:
HA+H₂O->H₃O⁺+A⁻
Di sini, HA sendiri termasuk ke dalam asam yang dapat melepaskan proton. Sementara itu, untuk A⁻ ini merupakan basa konjugasinya.
H₂O nantinya juga akan langsung bertindak sebagai basa. Sementara itu, H₃O⁺ yaitu asam konjugasinya.
Reaksi tersebut nantinya akan langsung mencapai keseimbangan pada titik tertentu. Sedangkan, untuk laju reaksi ke depan hampir sama dengan laju reaksi ke belakang.
4. Aplikasi dan Keterbatasan Teori
Teori asam basa Bronsted Lowry satu ini tentunya sudah mempunyai aplikasi yang cukup luas dalam kimia. Hal ini terutama dalam memahami berbagai macam reaksi pada larutan air dan proses biokimia.
Contohnya saja, teori ini tidak bisa langsung menjelaskan perilaku zat yang nantinya melibatkan transfer proton.
Misalnya saja seperti reaksi asam Lewis yang nantinya akan melibatkan pembentukan ikatan kovalen. Meskipun begitu, teori ini akan tetap menjadi dasar yang cukup penting.
Tujuannya tentu untuk bisa langsung memahami reaksi dari asam basa dalam berbagai macam konteks kimia.
Kesimpulan
Teori satu ini nantinya akan langsung memberikan kerangka kerja yang lebih kuat. Tujuannya untuk bisa langsung memahami reaksi kimia yang akan melibatkan proton. Hal ini memungkinkan para ilmuwan untuk bisa menjelaskan serta memprediksi perilaku dari berbagai macam zat dalam berbagai lingkungan kimia. Jadi diharapkan Teori asam basa Bronsted Lowry bisa bermanfaat bagi banyak orang.